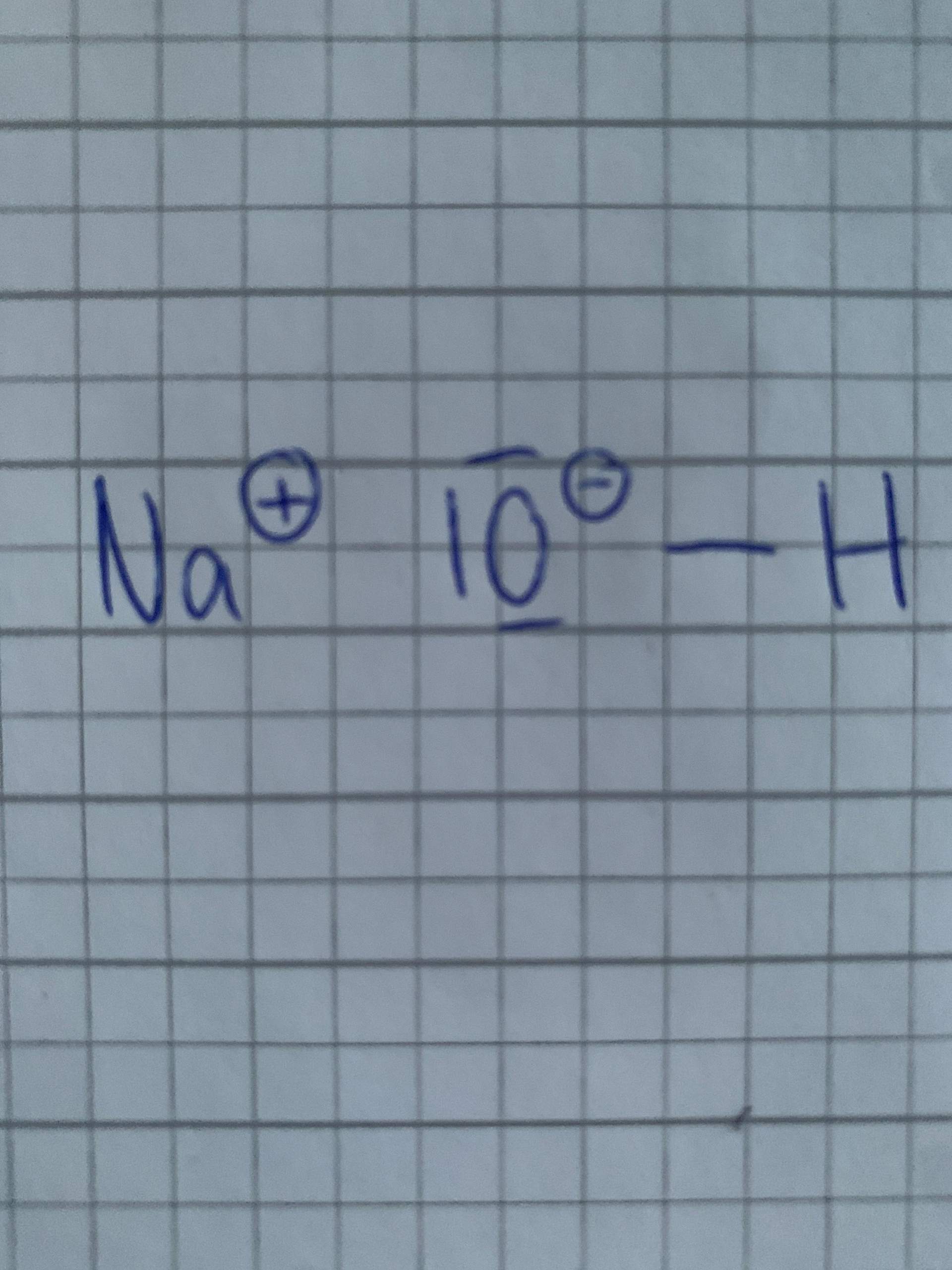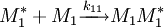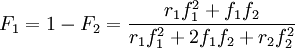L'équation de Mayo-Lewis concerne l'obtention de copolymères diblocs par polyaddition. Elle permet de relier la composition instantanée du copolymère (pourcentage d'unités A et B) à la composition du mélange de monomères (pourcentage de monomères A et B). Elle donne également une idée de la structure du copolymère : statistique, à bloc, alterné…
L'équation est la suivante :
Les concentrations en monomères sont données entre crochets. Les et sont les rapports de réactivité, caractéristiques d'un couple de monomères à une température donnée.
Contexte et démonstration
On synthétise un copolymère à partir des monomères A et B, en chaîne. À chaque addition d'un nouveau motif, on a quatre cas possibles:
On cherche à savoir quelle sera la proportion des unités monomères issues de A et B dans le copolymère formé. On peut écrire la vitesse de disparition des deux monomères:
Dans l'hypothèse de l'AEQS, La concentration en centres actifs reste constante.
En faisant le rapport des deux vitesses de disparition en tenant en compte de cette égalité, on obtient:
On peut introduire les rapports de réactivité: et .
On aboutit à:
C'est l'équation de Mayo-Lewis.
Calcul de composition
On définit les fractions molaires:
- des unités monomères dans le copolymère formé:
- des monomères dans le mélange de monomère:
alors l'équation de Mayo-Lewis devient:
À partir de cette relation, si on connait les rapports de réactivité, on peut calculer la composition d'un mélange de monomères à maintenir constante pour aboutir a un copolymère de composition donnée.
Répartition des motifs
Selon les valeurs des rapports de réactivité et , on peut avoir une idée de la structure du copolymère. Ainsi, si alors: . dans ce cas, l'unité monomère A réagira préférentiellement sur elle-même plutôt que sur une unité B. Un certain nombre de cas limites existent.
- et << 1: les unités réagissent préférentiellement sur l'autre type et on obtient un copolymère alterné:
- et : les unités réagissent sur elles-mêmes ou sur l'autre sorte indifféremment. Le copolymère est statistique:
- et : les unités de A réagissent entre elles et celles de b sur A aussi. Le copolymère enchaîne surtout des unités A avec quelques accidents de B, jusqu'à ce que beaucoup d'unités A soient consommées: .
- et : dans ce cas hypothétique la copolymérisation ne se ferait pas ou mal.
Pour se rendre compte de la dérive de composition, il suffit de tracer le diagramme de composition d'un monomère : . En effet, en analysant la courbe, si , alors le copolymère est plus riche en que le milieu réactionnel. On en déduit alors que le monomère est plus réactif que le monomère , donc on consomme préférentiellement du par rapport au . Par conséquent, le milieu s'appauvrit en ( diminue).
Calcul des rapports de réactivité
Si on pose: et , l'équation de Mayo-Lewis devient:
On peut préparer des copolymères de compositions différentes et tracer en fonction de . La courbe obtenue est une droite dont la pente et l'ordonnée à l'origine permettent de remonter aux rapports de réactivité. D'autres méthodes existent.
Notes et références
Article connexe
- Copolymère
- Portail de la chimie
![Lewis Formel • Beispiele, Elektronenschreibweise · [mit Video]](https://d3f6gjnauy613m.cloudfront.net/system/production/videos/001/875/a50bbcab3cda26871f45d32bf3da96639c4aa27d/Lewis_Formel_Thumbnail.png?1683199458)